TPE Savon
Comment la molécule de savon permet- elle de détacher la saleté de la peau ou des tissus ?
Le savon est un mélange de sels d'acides gras, depuis très longtemps, il est obtenu par saponification de diverses huiles végétales telles que les huiles de palme, de coco, d'olive, et les graisses animales, de bœuf, mouton, chèvre, etc. avec des sels de potassium (cendres de végétaux) ou de sodium (sel marin). La saponification se produit en effet lors du mélange d'un corps gras à un alcali à une température donnée.
Ce phénomène entraîne alors l'apparition du savon, un agent détergent tensioactif, c'est -à- dire qu'il peut modifier la tension superficielle entre deux surfaces. L'élément tensioactif peut être liquide ou solide et augmente le pouvoir mouillant de l'eau.
En effet, en temps normal, la tension de surface de l'eau est trop faible pour avoir un véritable effet mouillant : l'eau a tendance à glisser lorsqu'on la verse sur un tissu ou sur la peau, elle dégouline sous forme de gouttes.
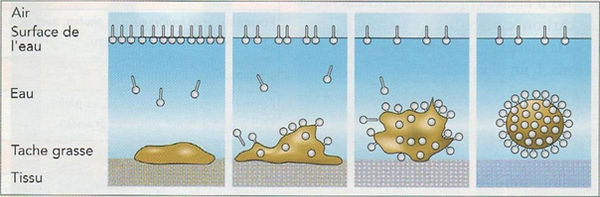
L’eau seule peut faire disparaître certaines saletés comme de la terre sur nos mains sans l’aide de savon. Cependant, elle ne peut faire de même avec de la graisse ou de l’huile. En effet, elle ne dissout pas les graisses, elle se contente de glisser dessus, sans les accrocher.
Bien qu’il existe différentes sortes de savons, l'efficacité du savon s'explique au niveau moléculaire : les propriétés chimiques du savon sont donc toujours les mêmes.
Les molécules sont constituées de deux parties :
- Une tête polaire (les charges sont réparties de façon asymétrique), soluble dans l’eau, composée d’un ion négatif, formé d’un atome de carbone et de deux atomes d’oxygène, et d’un ion positif comme le sodium. La tête est hydrophile : elle tente perpetuellement d'être en contact avec l’eau (hudôr : eau en grec + philos : ami) .
-Une queue, longue chaîne carbonée apolaire (sans pôle), constituée d’atomes de carbone et d’hydrogène. A l'inverse de la tête, la queue est dite hydrophobe (hudôr : eau en grec + phobos : aversion). Par ailleurs, elle s'allie très bien aux corps gras qui possèdent eux aussi de longues chaînes carbonées apolaires. On dit alors d'elle qu’elle est lipophile (lipos : graisse en grec + philos : ami).
http://operasavon.free.fr/action.htm
Schéma d’une molécule de savon
Les molécules possédant à la fois un groupe hydrophile et un groupe hydrophobe sont dites amphiphiles. C'est grâce à cette propriété que le savon permet le lavage : la queue, hydrophobe et lipophile, s’accroche aux graisses : les particules de savon orientent leur queue hydrophobe vers la graisse, elles s’insinuent entre le tissu et cette dernière. La graisse est alors suspendue, entourée de molécules de savon dont la tête hydrophile s'oriente vers l'eau.
Schéma représentatif de l'insertion de la queue lipophile de la molécule de savon dans une saleté graisseuse, de l'orientation de sa tête vers l'eau, et du phénomène de suspension qui s'en suit.
Les chaînes carbonées qui sont hydrophobes s'orientent hors de l'eau, donc vers l'air ou les unes vers les autres, en formant des micro bulles. Il se forme donc à la surface de la solution un film savonneux. En début de lavage, lorsque l'on plonge un tissu taché de graisse dans de l'eau savonneuse, les queues des molécules de savon, qui sont lipophiles, se dirigent vers le corps gras. La graisse est donc décollée du tissu et se retrouve dans l'eau savonneuse, piégée à l’intérieur des micelles. Une micelle est un regroupement sphéroïdal de molécules possédant une tête polaire hydrophile dirigée vers le solvant et une chaîne hydrophobe dirigée vers l'intérieur (comme les molécules de savon). Ensuite, ces micelles sont éliminées par le rinçage à l'eau, puisque les saletés sont détachées du tissu.
Quels sont les différents procédés de fabrication du savon ?
Il existe deux principaux procédés de fabrication pour le savon, dites "à chaud" et "à froid".
Ce premier, autrement connu sous le nom de "méthode marseillaise", est principalement utilsé dans le cadre industriel, il consiste à cuire longuement, au moins 10 jours, à un peu plus de 100°c, les différents composants. Les molécules de graisse et les molécules de soude se recombinent alors sous l'effet de la chaleur et forment un nouveau produit, composé de la glycérine, dont on se débarasse et le savon. C'est cette réaction chimique que l'on nomme "saponification", et elle opère jusqu'au point d'équilibre qui correspond à l'état final de la réaction et l'obtention d'une pâte de savon. Il est ensuite ajouté du sel, pour éliminer l'excès de soude et la glycérine contenue dans l'émulsion. Le savon est enfin lavé, afin d'enlever le sel, et versé dans des moules.
Ce deuxième procédé est celui utilisé par les petits fabriquants puisqu'il ne demande aucune cuisson. C'est en effet l'ajout de la soude caustique à l'eau qui produit une réaction entraînant de la chaleur. Le savon est ensuite soumis à un très long séchage, qui l'adoucit et atténue sa causticité.
Il est d'ailleurs préférable au procédé industriel, car il comporte plusieurs avantages : tout d'abord, il permet la conservation de la glycérine issue de la saponification, qui a un effet hydratant majeur, il est donc d'une qualité supérieure ; ensuite, l'absence de cuisson permet également la conservation de la qualité et propriétés des ingrédients utilisés. Enfin, ce procédé a un impact moindre sur l'environnement, car, contrairement aux savons industriels, qui sont la plupart du temps, obtenus à base de « bondillons », copeaux de savon produits en Afrique ou en Indonésie avec de l’huile de palme, favorisant la déforestation et le recul des forêts naturelles; ce procédé n'entraîne pas de soude résiduelle, et demande très peu d'énergie.